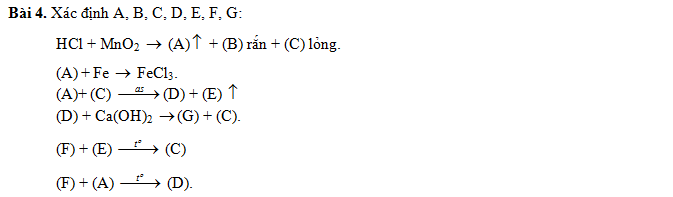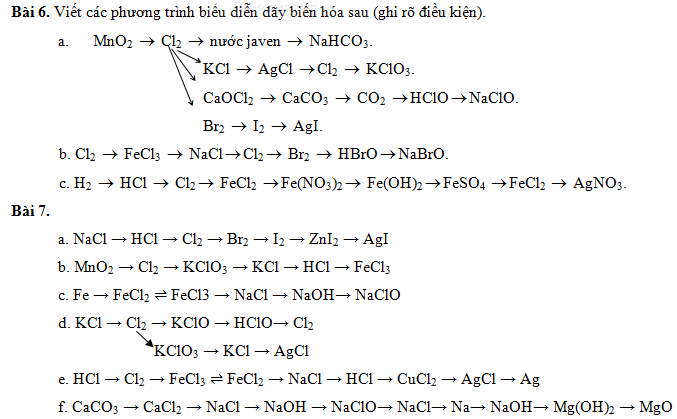Bài Tập Phương Trình Hóa Học Của Clo (Cl), Bài Tập Về Clo, Bài Tập Chuỗi Biến Hóa Về Clo
Bài viết nhằm mục đích củng cố kiến thức lý thuyết về clo, và nâng cao khả năng cân bằng phản ứng. Đồng thời khắc sâu tư duy hóa học cho học sinh
CHUỖI BIẾN HÓA VỀ CLO
Bài 2. Viết các phương trình phản ứng theo chuỗi biến hóa sau :
a. HCl →Cl2 → NaCl → HCl → CuCl →AgCl → Ag
b. Cl2 → HCl → AgCl → Cl2 → Br2 →I2
c. MnO2 → Cl2 →KClO3 → KCl → HCl → Cl2 → CaOCl2
Bài 3. Hoàn thành chuỗi phản ứng:
a. MnO2 →Cl2 →FeCl3 → Fe(OH)3 → FeCl3 →AgCl →Cl2.
Đang xem: Phương trình hóa học của clo
b. KMnO4 → Cl2 →HCl →CuCl2 → BaCl2 → BaSO4.
c. NaCl→ HCl → Cl2 → FeCl3 →NaCl →NaOH →NaCl →Cl2 →CaCl2 →AgCl →Ag.
d. NaCl →HCl →KCl →Cl2 →NaCl →H2 →HCl →Cl2 →CuCl2 →Cu(OH)2 →CuSO4 → K2SO4 →KNO3.
Xem thêm: Bảng Excel Tính Móng Đơn Bằng Excel Tính Móng Đơn Lệch Tâm, Độ Lún Miễn Phí
Bài 5. Bổ túc và cân bằng các pt theo sơ đồ:
a. HCl + ? → Cl2 + ? + ? b. ? + ? →CuCl2 + ?
c. HCl + ? →CO2 + ? + ? d. HCl + ? →AgCl + ?
e. KCl + ? →KOH + ? + ? f. Cl2 + ? →HClO + ?
g. Cl2 + ? NaClO + ? + ? h. Cl2 + ? CaOCl2 + ?
i. CaOCl2 + ? HClO + ? k. NaClO + NaHCO3 + ?
HƯỚNG DẪN VÀ ĐÁP ÁN
(Lời giải dưới đây chỉ hỗ trợ cho học sinh, các sơ đồ còn lại học sinh tự viết PTHH)
Bài 2.
a. Cl2 + 2Na → 2NaCl
2NaCl + H2SO4 đ → Na2SO4 + 2HCl
2HCl + CuO →CuCl2 + H2O
2CuCl + 2AgNO3 → Cu(NO3)2 + 2AgCl
2AgCl + Zn → ZnCl2 + 2Ag
b. Cl2 + H2 –a/s→ 2HCl
HCl + AgNO3 →AgCl + HNO3
2AgCl –đp→ 2Ag + Cl2
Cl2 + 2NaBr →2NaCl + Br2
Br2+ 2NaI → 2NaBr + I2
c. MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
3Cl2 + 6KOH (đ,n) –> 5KCl + KClO3 + 3H2O
2KClO3 —–tº→ 2KCl + 3O2 ( > 500 ºC)
2KCl + H2SO4 đ,n → K2SO4 + 2HCl
6HCl + KClO3 → KCl + 3H2O + 3Cl2
Cl2 + Ca(OH)2 → CaOCl2 + H2O
Bài 4.
|
(A) |
(B) |
(C) |
(D) |
(E) |
(F) |
(G) |
|
Cl2; |
MnCl2 |
H2O |
HCl |
O2 |
H2 |
CaCl2 |
Bài 5.
Xem thêm: Cách Tính Tiền Điện Máy Lạnh, Cách Tính Điện Năng Tiêu Thụ Của Máy Lạnh
a. HCl + MnO2 →Cl2 + H2O + MnCl2
b. CuO + HCl→CuCl2 + H2O
c. HCl + Na2CO3→CO2 + NaCl + H2O
d. HCl + AgNO3→AgCl + HNO3
e. KCl + H2O (đpdd , cmn) →KOH + Cl2 + H2O
f. Cl2 + H2O →HClO + HCl
g. Cl2 + NaOH → NaClO + NaCl + H2O
h. Cl2 + Ca(OH)2 đặc CaOCl2 + H2O
i. CaOCl2 + HCl HClO + CaCl2
k. NaClO + H2CO3 NaHCO3 + HClO
Bài 7.
a. NaCl + H2SO4 đ (t0) → NaHSO4 + HCl
4HCl + MnO2 (t0) → MnCl2 + Cl2 + 2H2O
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
I2 + Zn ((t0) → ZnI2
ZnI2 + 2AgNO3 → 2AgI↓ + Zn(NO3)2
c. Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 (t0) → 2FeCl3
2FeCl2 + Cl2 → 2FeCl3
2FeCl3 + 3NaOH → 3NaCl + Fe(OH)3
2NaCl + 2H2O (đpdd, có mn) → 2NaOH + Cl2 + H2
2NaOH + Cl2 → NaCl + NaClO + H2O
Tải về
Luyện Bài tập trắc nghiệm môn Hóa lớp 9 – Xem ngay