CáC Phương Trình Lưu Huỳnh Tác Dụng Với Oxi Lưu Huỳnh Cơ Bản Nhất
oxi + sulfua = lưu hùynh dioxit | Nhiệt độ 280 – 360, Điều kiện khác cháy trong không khí , hỗn hợp của SO3
Tính khối lượng SO2″ target=”_blank” href=”https://chemicalequationbalance.com/equation/O2+S=SO2-681″ class=”left btn btn-primary btn-sm” style=”margin-left:5px;”> English Version Tìm kiếm mở rộng
Phương Trình Hoá Học Lớp 8 Phương Trình Hoá Học Lớp 9 Phương Trình Hoá Học Lớp 10 Phản ứng hoá hợp Phản ứng oxi-hoá khử
| O2 | + | S | → | SO2 | oxi | sulfua | lưu hùynh dioxit | ||
| (khí) | (rắn) | (khí) | |||||||
| (không màu) | (vàng) | (không màu) | |||||||
| 32 | 32 | 64 | |||||||
| 1 | 1 | 1 | Hệ số | ||||||
| Nguyên – Phân tử khối (g/mol) | |||||||||
| Số mol | |||||||||
| Khối lượng (g) |
Điều kiện phản ứng
Nhiệt độ: 280 – 360°C Điều kiện khác: cháy trong không khí , hỗn hợp của SO3
Hiện tượng nhận biết
Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi mãnh liệt hơn, tạo thành khí lưu huỳnh đioxit SO2 (còn gọi là khí sunfurơ) và rất ít lưu huỳnh trioxit (SO3). Chất rắn màu vàng Lưu huỳnh (S) dần chuyển sang thể hơi.
Đang xem: Phương trình lưu huỳnh tác dụng với oxi
Phương Trình Điều Chế Từ O2 Ra SO2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từO2 (oxi) raSO2 (lưu hùynh dioxit)
Xem tất cả phương trình điều chế từ O2 (oxi) ra SO2 (lưu hùynh dioxit)
Phương Trình Điều Chế Từ S Ra SO2
Trong thực tế, sẽ có thể nhiều hơn 1 phương pháp điều chế từS (sulfua) raSO2 (lưu hùynh dioxit)
Xem tất cả phương trình điều chế từ S (sulfua) ra SO2 (lưu hùynh dioxit)
Phản ứng hoá hợp
Trong phản ứng hóa hợp, số oxi hóa của các nguyên tố có thể thay đổi hoặc không thay đổi. Như vậy, phản ứng hóa hợp có thể là phản ứng oxi hóa – khử hoặc không phải là phản ứng oxi hóa – khử.Phản ứng hoá học là loại phản ứng xuất hiện nhiều trong chương trình Hoá trung học cơ sở, phổ thông cho tới Ôn Thi Đại Học.
Xem tất cả Phản ứng hoá hợp
Phản ứng oxi-hoá khử
Phản ứng oxi hóa khử thường liên quan đến việc chuyển giao điện tử (electron) giữa các đối tượng hóa học.Để hiểu được trọn vẹn phản ứng oxi hoá khử bạn cần hiểuChất khử: chất khử là chất cho electron, nói cách khác, chất khử sẽ có số oxi hoá tăng sau khi phản ứng xảy ra. Trong định nghĩa của chương trình phổ thông, chất khử cũng được gọi là chất bị oxi hoá.Chất oxi hoá: ngược lại với chất khử, là chất nhận electron. Chất oxi hoá có số oxi hoá tăng sau phản ứng. Chất oxi hoá, trong định nghĩa của chương trình phổ thông còn được gọi là chất bị khừ.
Xem tất cả Phản ứng oxi-hoá khử
Advertisement
Câu hỏi minh họa
SO2″>Click để xem tất cả câu hỏi có liên quan tới phương trình O2 + S => SO2
Câu 1. Chọn nhận định đúng
Cho các phát biểu và nhận định sau:(1). Tác nhân chủ yếu gây mưa axit là H2S và NO.(2). Khí CH4; CO2 gây ra hiện tượng hiệu ứng nhà kính(3). Chất gây nghiện chủ yếu trong thuốc lá là nicotin.(4). Ozon trong khí quyển là nguyên nhân gây ô nhiễm không khíSố phát biểu đúng là:
A. 2 B. 4 C. 3 D. 1 Xem đáp án câu 1
Câu 2. Lưu huỳnh thề hiện tính khử
Cho các phản ứng hóa học sau:(a) S + O2 → (t0) SO2;(b) S + 3F2 (t0)→ SF6;(c) S + Hg → HgS;(d) S + 6HNO3 đặc (t0)→ H2SO4 + 6NO2 + 2H2OSố phản ứng trong đó S thể hiện tính khử là:
A. 2 B. 3 C. 1 D. 4 Xem đáp án câu 2
Câu 3. Phản ứng tạo khí SO2
Trong các hóa chất Cu, C, S, Na2SO3, FeS2, FeSO4; O2, H2SO4 đặc. Chotừng cặp chất phản ứng với nhau thì số cặp chất có phản ứng tạo ra khí SO2 là:
A. 6 B. 7 C. 9 D. 8 Xem đáp án câu 3
Câu 4. Chất tác dụng với lưu huỳnh
Dãy gồm các chất đều tác dụng (trong điều kiện phản ứng thích hợp) vớilưu huỳnh là:
A. H2, Pt, F2. B. Zn, O2, F2.C. Hg, O2, HCl. D. Na, Br2, H2SO4 loãng.Xem đáp án câu 4
Câu 5. Phản ứng lưu huỳnh thể hiện tính khử
Cho đơn chất lưu huỳnh tác dụng với các chất: O2; H2; Hg; HNO3 đặc,nóng; H2SO4 đặc, nóng trong điều kiện thích hợp. Số phản ứng trong đó lưuhuỳnh thể hiện tính khử là
A. 5 B. 2 C. 4 D. 3 Xem đáp án câu 5
Đóng góp nội dung
Từ Điển Phương Trình đã xây dựng một công cụ tìm kiếm mở rộng kết hợp với Google Vietnam
Click vào đây để tìm kiếm thông tin mở rộng
Báo lỗi cân bằng
Nếu bạn nhận ra phương trình này chưa được cân bằng chính xác. Hãy click vào nút bên dưới để thông báocho chúng mình biết nhé
Click vào đây để báo lỗi
Chuỗi phản ứng về oxi lưu huỳnh
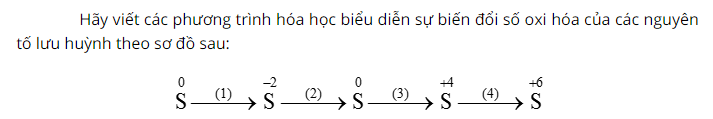
Cho lưu huỳnh phản ứng với khí hidro sản phẩm tạo thành là khí hidro sunfua (H2S) có mùi trứng thối, mùi sốc.
Tiếp tục cho khí H2S phản ứng với oxi sau phản ứng thu được lưu huỳnh và nước.
Sau đó, đốt cháy lưu huỳnh trong không khí, sau phản ứng có khí không màu, mùi hắc thoát ra là khí SO2.
Cuối cùng, sục khí SO2 trong dung dịch nước Br2 sản phẩm thu được có axit sunfuric.
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click “xem chi tiết” để thấy toàn bộ
1 H2S” class=”btn btn-primary”>H2 + S => H2S
2 H2O + S” class=”btn btn-primary”>2H2S + O2 => 2H2O + 2S
Chuỗi phản ứng về oxi lưu huỳnh

Nhiệt phân muối kali clorat ởnhiệtđộ 500 độ C, sản phẩm thu được là muối kali clorua.
Sự tạo thành: một phân tử oxy bị tách(quangly) bởi tia UV tần số cao thành hai nguyên tử oxy
O2 +ℎν → 2 O•
Mỗi nguyên tử oxy sau đó nhanh chóng kết hợp lại với một phân tử oxy để tạo thành một phân tử ôzôn:
O• + O2 → O3
Cho Ag phản ứng với O3 thu được Ag2O có màu đen nâu và khí oxi thoát ra.
Oxi hóa hóa kẽm trong không khí sau phản ứng thu được ZnO màu trắng.
Cho ZnO phản ứng với axit H2SO4 sản phẩm tạo thành là muối kẽm sunfat.
Tiếp theo, cho FeS tác dụng với dung dịch axit HCl sản phẩm sau phản ứng có màu lục nhạt là muối FeCl2 và khí H2S mùi trứng thối thoát ra.
Tiếp tục cho H2S đốt cháy trong điều kiện thiếu oxi sau phản ứng ta thu được lưu huỳnh.
Sau đó lấy lưu huỳnh đốt cháy trong không khí ta thu được khí lưu huỳnh đioxit mùi hắc.
Cho SO2 tác dụng với CaO thu được muối CaSO3.
Cho CaSO3 tác dụng với axit sunfuric sản phẩm tạo thành có khí mùi sốc thoát ra là SO2.
Phương trình liên quan
Có 10 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click “xem chi tiết” để thấy toàn bộ
1 KCl + O2″ class=”btn btn-primary”>2KClO3 => 2KCl + 3O2
2 O3″ class=”btn btn-primary”>3O2 => 2O3
Chuỗi phản ứng về oxi lưu huỳnh
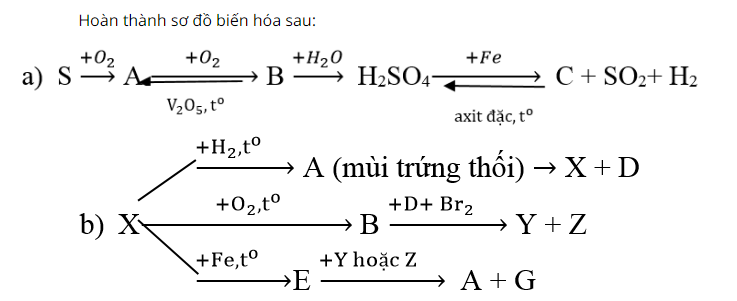
Đốt cháy lưu huỳnh trong không khí sản phẩm thu được là khí không màu, mùi hắc SO2.
Đốt cháy SO2 trong không khí có chất xúc tác V2O5, nhiệt độ 450 độ C sản phẩm tạo thành là SO3.
Tiếp tục hòa tan khí SỎ trong nước ta sẽ thu được dung dịch axit sunfuric.
Tiếp theo, cho kim loại sắt phản ứng với axit sunfuric đậm đặc, sản phẩm tạo thành có Fe2(SO4)3, khí SO2 không màu thoát ra.
Đốt cháy lưu huỳnh với khí hidro ta thu được khí có mùi trứng thối là H2S.
Tiếp theo đốt cháy lưu huỳnh trong không khí tạo thành khí SO2.
Cho kim loại sắt phản ứng với lưu hình sản phẩm tạo thành chất rắn màu đen là FeS.
Dẫn khí SO2 vào dung dịch Axit Sunfuhiđric H2S, xuất hiện kết tủa vàng Lưu huỳnh (S).
Sục khí SO2 trong dung dịch nước brom thu được axit sunfuric.
Tiếp theo cho FeS tác dụng với HBr thu được sản phẩm có mùi trứng thối thoát ra đó là H2S
Phương trình liên quan
Có 9 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click “xem chi tiết” để thấy toàn bộ
1 SO2″ class=”btn btn-primary”>O2 + S => SO2
2 SO3″ class=”btn btn-primary”>O2 + 2SO2 => 2SO3
Chuỗi phản ứng về oxi lưu huỳnh
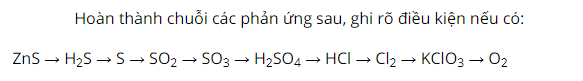
Cho ZnS tác dụng với axit clohidric, sản phẩm tạo thành có khí mùi trứng thối thoát ra là H2S.
Tiếp tục cho khí H2S đốt cháy trong điều kiện thiếu oxi sản phẩm thu được là lưu huỳnh.
Đốt cháy lưu huỳnh trong không khí thu được sản phẩm là khí SO2 không màu, mùi hắc.
Xem thêm: Bài Tập Toán 5 Trang 100 Tập 1, Giải Bài 1, 2, 3 Trang 100 Sgk Toán 5
Đem khí SO2 đốt cháy trong không khí có chất xúc tác V2O5, nhiệt độ 450 độ C sản phẩm tạo thành là SO3.
Hòa tan SO3 trong nước ta thu được axit sunfuric.
Tiếp theo, cho tinh thể NaCl tác dụng với axit H2SO4 đặc sản phẩm ta thu được axit HCl.
Sau đó cho axit HCl phản ứng với MnO2 sản phẩm có khí clo thoát ra.
Sục khí clo trong dung dịch KOH ở nhiệt độ 100 độ C ta thu được muối kali clorat.
Nhiệt phân muối kali clorat ở nhiệt độ cao, chất xúc tác MnO2 có khí oxi thoát ra và thu được muối KCl.
Phương trình liên quan
Có 8 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click “xem chi tiết” để thấy toàn bộ
1 H2S + ZnCl2″ class=”btn btn-primary”>2HCl + ZnS => H2S + ZnCl2
2 H2O + S” class=”btn btn-primary”>2H2S + O2 => 2H2O + 2S
Chuỗi phản ứng về oxi lưu huỳnh
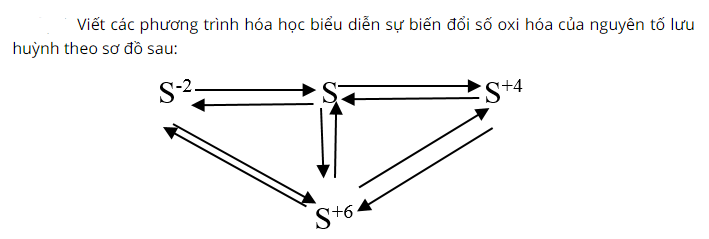
+) S-2→ S0: Đốt cháy khí H2S trong điều kiện thiếu oxi sản phẩm thu được kết tủa vàng là S.
+) S0→ S-2: Cho S phản ứng với hidro sản phẩm có khí mùi trứng thối thoát ra.
+) S0→ S+4: Đốt cháy lưu huỳnh trong không khí thu được khí SO2 không màu.
+) S+4→ S0: Cho khí H2S tác dụng với SO2 sản phẩm thu được kết tủa vàng là lưu huỳnh
+) S+4→ S+6: Sục khí SO2 với dung dịch nước brom sản phẩm thu được axit sunfuric
+) S+6→ S+4: Cho kim loại đồng phản ứng với H2SO4 đặc sản phẩm thu được có khí SO2 thoát ra.
+) S0→ S+6: Cho lưu huỳnh tác dụng với flo sản phẩm thu được là SF6
+) S+6→ S0: Tiếp theo cho kẽm hòa tan trong dung dịch axit sunfuric sản phẩm có muối ZnSO4 và lưu huỳnh kết tủa
+) S-2→ S+6: Sục khí H2S trong dung dịch clo sản phẩm thu được là axit H2SO4
+) S+6→ S2-: Hòa tan Mg trong dung dịch axit H2SO4 đặc ta thu được muối MgSO4
Phương trình liên quan
Có 9 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click “xem chi tiết” để thấy toàn bộ
1 H2O + S” class=”btn btn-primary”>2H2S + O2 => 2H2O + 2S
2 H2S” class=”btn btn-primary”>H2 + S => H2S
Chuỗi phản ứng về oxi lưu huỳnh
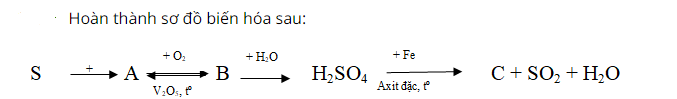
Đốt cháy lưu huỳnh trong không khí thu được lưu huỳnh đioxit mùi hắc, không màu (chất A).
Tiếp tục đem SO2 đốt cháy trong không khí ở nhiệt độ cao sản phẩm tạo thành là SO3.
Sau đó, hòa tan SO3 trong nước sản phẩm thu được dung dịch axit H2SO4.
Cuối cùng, cho kim loại sắt hòa tan trong dung dịch axit sunfuric đặc, sản phẩm tạo thành có khí không màu thoát ra và muối Fe2(SO4)3.
Phương trình liên quan
Có 3 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click “xem chi tiết” để thấy toàn bộ
1 SO2″ class=”btn btn-primary”>O2 + S => SO2
2 SO3″ class=”btn btn-primary”>O2 + 2SO2 => 2SO3
Chuỗi phản ứng về oxi lưu huỳnh
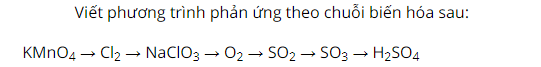
Cho KMnO4 hòa tan trong dung dịch axit HCl sau phản ứng có khí màu vàng thoát ra là clo.
Sau đó, sục khí clo qua dung dịch kiềm NaOH sản phẩm tạo thành có muối natri clorat NaClO3.
Nhiệt phân muối natri clorat sản phẩm có khí không màu thoát ra là oxi.
Tiếp tục cho oxi phản ứng với lưu huỳnh, sản phẩm thu được là khí SO2.
Sau đó, cho khí SO2 phản ứng với oxi sản phẩm tạo thành là chất lỏng, không màu.
Tiếp tục hòa tan SO3 trong nước ta thu được dung dịch axit H2SO4.
Phương trình liên quan
Có 5 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click “xem chi tiết” để thấy toàn bộ
1 Cl2 + H2O + KCl + MnCl2″ class=”btn btn-primary”>16HCl + 2KMnO4 => 5Cl2 + 8H2O + 2KCl + 2MnCl2
2 H2O + NaCl + NaClO3″ class=”btn btn-primary”>3Cl2 + 6NaOH => 3H2O + 5NaCl + NaClO3
Chuỗi phản ứng về phi kim
Đốt cháy lưu huỳnh trong không khí, sản phẩm tạo thành là khí không màu thoát ra SO2.
Tiếp tục đem khí lưu huỳnh đioxit đốt trong không khí, sản phẩm tạo thành là chất lỏng không màu SO3.
Sau đó, hòa tan SO3 trong môi trường nước, ta thu được axit sunfuric.
Cho axit sunfuric phản ứng với dung dịch natri hidroxit sản phẩm tạo thành là muối natri sunfat.
Xem thêm: Vở Bài Tập Toán Lớp 3 Tập 2 Trang 29, Giải Vở Bài Tập Toán Lớp 3 Hay Và Chi Tiết Nhất
Cuối cùng cho muối natri sunfat phản ứng với bari clorua sau phản ứng có hiện tượng kết tủa trắng là BaSO4
Phương trình liên quan
Có 4 phương trình phản ứng hóa học liên quan tới chuỗi này.
Hiển thị tối đa 3 phương trình
Vui lòng click “xem chi tiết” để thấy toàn bộ
1 SO2″ class=”btn btn-primary”>O2 + S => SO2
2 SO3″ class=”btn btn-primary”>O2 + 2SO2 => 2SO3















