Hãy Viết Phương Trình Chứng Minh Hcl Có Tính Axit, Bài 32 A3 Axit Hcl Có Tỉnh Khử Và T
Tất cả Lớp 12 Lớp 11 Lớp 10 Lớp 9 Lớp 8 Lớp 7 Lớp 6 Lớp 5 Lớp 4 Lớp 3 Lớp 2 Lớp 1



Carbonic acid is weaker than hydrochloric acid: + If Na2CO3 reacts with HCl, there is a reaction to create NaCl + H2O + CO2 + But if NaCl reacts with H2CO3, it will not create HCl and Na2CO3 => HCl is stronger than H2CO3 Equation (1) also proves that H2CO3 is a weak acid, it decomposes into water and CO2.
Đang xem: Viết phương trình chứng minh hcl có tính axit
tiking me !translate it yourself!
Dẫn ra phương trình hóa học chứng minh S O 2 vừa có tính oxi hóa, vừa có tính khử và giải thích ngắn gọn.
Cho 65g kẽm tác dụng với axit clohidric (HCl) a/. Viết phương trình phản ứng b/. Tính thể tích hiđro thu được ở đktc c/. Dẫn khí hiđro thoát ra ở trên khử đồng (II) oxit ở nhiệt độ cao hãy tính khối lượng đồng tạo thành
nZn = 65/65 = 1 (mol)
Zn + 2HCl => ZnCl2 + H2
1__________________1
VH2 = 1 * 22.4 = 22.4 (l)
CuO + H2 -to-> Cu + H2O
______1_______1
mCu = 1*64 = 64 (g)
Câu 2:a. Cho biết tính chất hóa học của khí HCl và viết pthh minhhọa?b. Dựa vào tính chất hóa học chung của axit hãy dự đoán tính chất hóa học của axit HCl? Viết pthh minh họa.c. Phương pháp điều chế axit HCl trong PTN và trong côngnghiệp?Câu 3: Thuốc thử nhận biết ion Cl-? Hiện tượng? Viết pthh.
Câu 2
a) Khí HCl không có tính chất hóa học vì nó tan vào nước tạo thành axit clohidric
b) Tính chất của axit clohidric
– Làm quỳ tím hóa đỏ
– Tác dụng với kim loại trước H tạo khí hidro và muối clorua
VD:(Mg+2HCl
ightarrow MgCl_2+H_2uparrow)
– Tác dụng với bazơ (tan và không tan) tạo muối và nước
VD:(KOH+HCl
ightarrow KCl+H_2O)
(Feleft(OH
ight)_3+3HCl
ightarrow FeCl_3+3H_2O)
– Tác dụng với oxit bazơ tạo muối và nước
VD:(MgO+2HCl
ightarrow MgCl_2+H_2O)
– Tác dụng với muối tạo muối mới và axit mới
VD:(HCl+AgNO_3
ightarrow HNO_3+AgCldownarrow)
– HCl đặc là chất khử mạnh
VD:(2KMnO_4+16HCl
ightarrow2KCl+2MnCl_2+5Cl_2+8H_2O)
c) Điều chế trong PTN
(2NaCl_{left(rắn
ight)}+H_2SO_{4left(đ
ight)}underrightarrow{t^o}Na_2SO_4+2HCluparrow)
Đúng 0
Bình luận (0)
Câu 3:
– Thuốc thử: dd Bạc Nitrat (AgNO3)
– Hiện tượng: Xuất hiện kết tủa trắng (AgCl)
– Lấy ví dụ là KCl
PTHH:(KCl+AgNO_3
ightarrow KNO_3+AgCldownarrow)
Đúng 0
Bình luận (0)
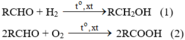
Viết các phương trình hóa học để chứng tỏ rằng, anđehit vừa có tính oxi hóa vừa có tính khử.
Lớp 11 Hóa học
1
0
Gửi Hủy
Trong (1), anđehit đóng vai trò là chất oxi hoá
Trong (2), anđehit đóng vai trò là chất khử.
Đúng 0
Bình luận (0)
Viết PT chứng minh từ HF đến HI tính axit tăng, tính khử giảm
Lớp 10 Hóa học Chương 5. Nhóm Halogen
1
0
Gửi Hủy
tính khử tăng chứ bạn :v nhóm halogen thì tính oxi hóa giảm thôi chứ tính khử tăng
trong nhóm halogen thì tính oxi hóa giảm: mạnh nhất là flo yếu nhất là iot
Từ HF —> HI tính axit tăng dần.
Xem thêm: Khóa Học Sketch (Sáng Tạo Nhân Vật & Storyboard), Trang Chủ Lớp Học Design Sketching
Lý do:
-Từ F —> I bán kính nguyên tử tăng dần. Xét quá trình phân ly tạo ra ion H+ của các axit HX ( X = halogen ): HX —> H+ + X– Từ HF —> HI do bán kính halogen tăng dần nên độ bền liên kết H-X kém bền dần, dễ đứt ra theo kiểu dị li để tạo ra cation và anion.
– Các anion tương ứng X- được tạo ra theo thứ tự từ F- —> I- có độ bền tăng dần do mật độ điện tích âm được giải tỏa rộng hơn .=> Kết luận cuối cùng về thứ tự tăng dần tính axit.
– Có thể có ai đó còn thắc mắc là tại sao flo có độ âm điện rất caodo vật liên kết H-F sẽ rất phân cực và khả năng phân ly ra ion hiđroni của HF phải rất cao => tính axit của nó phải mạnh. Tuy nhiên cần lưu ý rằng chính vì có độ âm điện cao và bán kính bé nên H-F tồn tại ở dạng polyme mạch thẳng do tạo liên kết hiđro :-(– H-F — H-F — H-F –)- ở đây kí hiệu “—” là chỉ liên kết hiđro. Liên kết hiđro sẽ làm cho nguyên tử H bị giữ chặt hơn và việc tách ion hiđroni H+ ra sẽ khó khăn hơn => tính axit của HF không cao.Nếu xét sâu hơn ta sẽ còn thấy các ảnh hưởng của dung môi , tuy nhiên trong box PT này không nên nói quá nhiều về vấn đề này. (Nếu bạn nào còn muốn tham khảo thêm thì có thể tìm kiếm thông tin ở một số diễn đàn Hóa học lớn như Olympiavn.org hoặc Chemvn.net)
CM tính khử của các halogen tăng dần theo thứ tự: HF → HCl → HBr → HI.
-Ta có thể dùng pư của axit halagenua với H2SO4 đặc, xem các sản phẩm để KĐ tính khử mạnh hay yếu.
-Hoặc ta có thể dùng các pư sau:Cl2 + 2HBr → 2HCl + Br2.Br2 + 2HI → 2HBr + I2. Qua các pư trên cho ta thấy Br2 có tính oxi hóa mạnh hơn I2; HI có tính khử mạnh hơn HBr.
Xem thêm: Câu 1, 2, 3 Trang 43 Vở Bài Tập Toán Lớp 5 Trang 43 Tập 1, Database Error
– Cl2 có tính oxi hóa mạnh hơn Br2; HBr có tính khử mạnh hơn HCl.(do : chất khử mạnh hơn bị oxi hóa thành chất khử yếu hơn và chất oxi hóa mạnh hơn bị khử thành chất oxi hóa yếu hơn). Và theo tính chất bắc cầu, ta có: Cl2 > Br2 > I2 (xét về tính oxi hóa)HI > HBr > HCl (xét theo tính khử)Ngoài ra ta còn có thể so sánh giữa F2 và các halogen khác: F2 có tính oxi hóa rất mạnh, nó phân hủy nước ở nhiệt độ thường tạo thành HF và O2. (điều này các halogen khác không làm được)HF là 1 axit yếu, nó phân li không hoàn toàn trong dd, và để CM nó yếu hơn HCl hay HBr, HI thì ta có thể cho nó t/d với 1 kim loại như Al chẳng hạn.